Dipolar EPR コンポーネント
特長
・ESRによる微小な距離(8-25Å)の測定
・非晶質や凍結溶液内の高分子化合物の構造解析やコンフォメーション変化の追跡が可能
Diploar EPRとは
 高分子化合物の構造解析には通常X線結晶構造解析が用いられますが、その測定に耐え得る高分子の結晶が必要であり、その結果が実際の溶液中の構造を反映しているとは限りません。高分解能NMRという選択肢も3次元構造を描出するには力不足です。また、最新の生化学においては遺伝子レベルの研究の進歩は凄まじいものがあり、タンパク質の一次構造を対象としたツールは非常に発達している一方、実際のタンパク質の活性発現に深く関与する溶液中におけるタンパク質の動的な構造変化や複数のタンパク質の会合状態の変化を検出する測定方法は限られています。 そこで登場するのがDipolar EPRです。
高分子化合物の構造解析には通常X線結晶構造解析が用いられますが、その測定に耐え得る高分子の結晶が必要であり、その結果が実際の溶液中の構造を反映しているとは限りません。高分解能NMRという選択肢も3次元構造を描出するには力不足です。また、最新の生化学においては遺伝子レベルの研究の進歩は凄まじいものがあり、タンパク質の一次構造を対象としたツールは非常に発達している一方、実際のタンパク質の活性発現に深く関与する溶液中におけるタンパク質の動的な構造変化や複数のタンパク質の会合状態の変化を検出する測定方法は限られています。 そこで登場するのがDipolar EPRです。
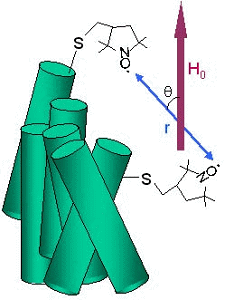
右図のように、タンパク質のうちの興味ある部位の近傍の2ヶ所にニトロキシドを導入してその凍結溶液のESRを測定します。2つのニトロキシドスピンは電磁石による磁場(H0)のほかに相手のスピンによって生じる磁場も感じるため、単独に存在する場合と比べ共鳴磁場が変化します。更にその変化量は2つのニトロキシドスピンを結ぶ直線と電磁石磁場のなす角度θによって変化します。凍結溶液中ではタンパク質の配向はランダムなので、あらゆるθに対応したESRスペクトルが重なる結果、見かけ上は単独のESR信号の線幅が拡がった状態になり、その拡がりの程度がスピン間距離rの3乗に反比例します。この関係からESRスペクトル線型を解析するとスピン間距離が逆に求まります。
Diploar EPRで得られる情報
Dipolar EPRによって、以下のような解析が可能になります。
(1) 一次構造が既知だが高次構造の不明なタンパク質内の注目するサイト間の溶液中の距離を知る。
(2) 基質、リガンド、イオン、阻害剤などの低分子の投与前後でのタンパク質の活性中心の構造変化を特定の残基間の距離の変化から推定する。
(3) 何らかの刺激で会合または分離することが予想される2種類のタンパク質に別々にスピンラベルを行い、刺激前後のスペクトル変化から会合/分離の有無、会合のインターフェースを明らかにする。
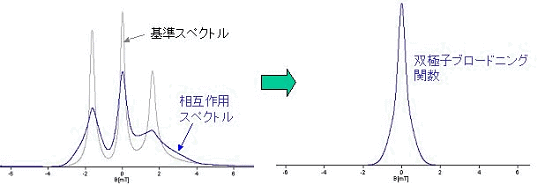
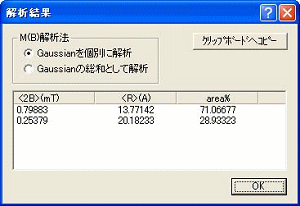
Dipolar EPRコンポーネントは、上記の解析を容易に行うツールです。まず、1箇所のみをスピンラベルしたタンパク質の凍結溶液のESRスペクトルを基準スペクトルとして測定し、次に近接する2ヶ所をラベルしたもののスペクトルを相互作用スペクトルとして測定します。本コンポーネントはこの2つのスペクトルの中心位置を重ねて積分してESR吸収スペクトルを計算し(上図左)、それを基にフーリエ変換を用いた解析を行って双極子ブロードニング関数を導出します(上図中央)。この関数が含む距離の情報からスピン間の距離を算出します。凍結溶液中のタンパク質のコンフォメーションが2個以上ある場合でも、それぞれをうまく分離して解析できる場合があります(右上図解析結果)。
文献
1. Xiao W and Shin YK: EPR Spectroscopic Ruler: Method and its Applications. In: Biological Magnetic Resonance 19: Distance Measurements in Biological Systems by EPR pp 249-276. ed by Berliner et al. Kluwer Academic/Plenum Publishers, New York, 2000
2. Rabenstein MD, Shin YK: Determination of the distance between two spin labels attached to a macromolecule. Proc Natl Acad Sci USA 92:8239-8243 (1995))